- 硼的化合物
- 硼的化合物可分为硼的氧化物,硼的氢化物-硼烷,硼氢化物,卤化硼,氟硼酸,硼酸,多硼酸盐-硼砂,金属硼化物,硼杂环化合物及硼的其它化合物(过硼酸盐,氮化硼)等。
 硼化合物应用尤为广泛,硼砂和硼酸是应用最广泛的化合物,硼砂主要用作玻璃和搪瓷工业原料,其作用是增加玻璃的紫外线透射率,提高玻璃的透明度和耐热性能,使瓷釉不易脱落且具有光泽。此外,硼砂还用于有色金属焊接,丝、毛织品洗涤,延迟橡胶硫化速度,织物防水,木材防腐,医用消毒以及制革造纸等方面。硼酸能提高玻璃的机械强度,缩短玻璃熔融时间,改善玻璃制品的耐热和透明性能,主要用于制造无碱玻璃和玻璃纤维。此外,硼酸也可作防腐消毒剂、熏蒸剂、皮革后处理剂等,还可用于制造防火材料、肥皂、染料、颜料等。另外有机硼化合物除在有机合成方面有广泛的应用外,还可用作聚合反应的引发剂、煤油抗氧剂、杀菌剂、抗癌药和用于中子俘获、治疗脑肿瘤。
硼化合物应用尤为广泛,硼砂和硼酸是应用最广泛的化合物,硼砂主要用作玻璃和搪瓷工业原料,其作用是增加玻璃的紫外线透射率,提高玻璃的透明度和耐热性能,使瓷釉不易脱落且具有光泽。此外,硼砂还用于有色金属焊接,丝、毛织品洗涤,延迟橡胶硫化速度,织物防水,木材防腐,医用消毒以及制革造纸等方面。硼酸能提高玻璃的机械强度,缩短玻璃熔融时间,改善玻璃制品的耐热和透明性能,主要用于制造无碱玻璃和玻璃纤维。此外,硼酸也可作防腐消毒剂、熏蒸剂、皮革后处理剂等,还可用于制造防火材料、肥皂、染料、颜料等。另外有机硼化合物除在有机合成方面有广泛的应用外,还可用作聚合反应的引发剂、煤油抗氧剂、杀菌剂、抗癌药和用于中子俘获、治疗脑肿瘤。- 硼化合物的简单介绍如下:
 无定形硼在空气中燃烧,生成三氧化二硼(B2O3),还可生成少量BN。三氧化二硼又称氧化硼、硼酐、硼酸酐,英文名称:Boric oxide,又称Boron oxide、boric anhydride,是硼最主要的氧化物。三氧化二硼B2O3的熔点为445℃,沸点为1500℃,密度1.85g/cm³;是一种无色玻璃状固体,一般以无定形的状态存在,很难形成晶体,但在高强度退火后也能结晶;它是已知的最难结晶的物质之一。溶于酸和乙醇,微溶于冷水,溶于热水,形成硼酸(H3BO3),但遇热的水蒸气可生成易挥发的偏硼酸HBO2,由于B-O键能大,即使在高温下也只能被强还原剂镁或铝所还原。熔融玻璃体B2O3可以溶解多种金属氧化物得到有特征颜色的玻璃,也用此来作定性鉴定。
无定形硼在空气中燃烧,生成三氧化二硼(B2O3),还可生成少量BN。三氧化二硼又称氧化硼、硼酐、硼酸酐,英文名称:Boric oxide,又称Boron oxide、boric anhydride,是硼最主要的氧化物。三氧化二硼B2O3的熔点为445℃,沸点为1500℃,密度1.85g/cm³;是一种无色玻璃状固体,一般以无定形的状态存在,很难形成晶体,但在高强度退火后也能结晶;它是已知的最难结晶的物质之一。溶于酸和乙醇,微溶于冷水,溶于热水,形成硼酸(H3BO3),但遇热的水蒸气可生成易挥发的偏硼酸HBO2,由于B-O键能大,即使在高温下也只能被强还原剂镁或铝所还原。熔融玻璃体B2O3可以溶解多种金属氧化物得到有特征颜色的玻璃,也用此来作定性鉴定。 - 从硼的燃烧热及B-O键的键能可知硼与氧的亲和力超过硅,所以它能从许多稳定的氧化物(如SiO2,P2O5,H2O等)中夺取氧而用作还原剂。它在炼钢工业中用作去氧剂。
- 烃基硼酸是有机硼氧化合物。通常用卤化硼或硼酸酯的格氏反应制备。
- 硼的氢化物是指硼与氢组成的化合物的总称,又称为硼烷,英文名称Borane,它可以用化学通式BxHy表示。这类化合物都是通过人工合成得到的。硼烷分子有两种类型:BnHn+4和BnHn+6 。现在已制得二十多种硼烷。主要有乙硼烷(B2H6)、丙硼烷(B3H9)、丁硼烷(B4H10)、戊硼烷(B5H11)、己硼烷(B6H12)和癸硼烷。具体内容请参见硼烷页面。
- 硼氢化物
- 硼氢化物是一类含有BH4−离子的化合物。硼氢化物无论对于无机物的制备还是有机物的合成都是非常重要的试剂。
- B2H6与LiH反应,将得到一种比B2H6的还原性更强的还原剂硼氢化锂LiBH4,LiBH4的燃烧热很高,可作火箭燃料。让过量的NaH与BF3反应,或让NaH与硼酸三甲脂B(OCH3)3反应,可得到硼氢化钠NaBH4。
- 硼氢化物都是白色盐型化合物晶体,能溶于水或乙醇,无毒,化学性质稳定。由于其分子中有BH4-离子(即H-离子),它们是极强的还原剂。在还原反应中,它们各有选择性(例如NaBH4只还原醛、酮和酰氯类)且用量少,操作简单,对温度又无特殊要求,在有机合成中副反应少,这样就使得一些复杂的有机合成反应变得快而简单,并且产品质量好。它在制药、染料和精细化工制品(作为制氢化物的起始原料)的生产中已得到越来越广泛的应用。
- 硼与卤族元素组成的化合物称之为卤化硼,硼的四种卤化物BX3均已制得,它们的一些物理性质列于下表中。
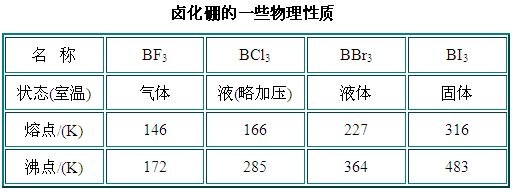
- 它们都是共价化合物,易溶于非极性溶剂,都易于水解。这些化合物都是缺电子化合物,是很强的路易士酸,因此,都易于和具有孤电子对的物质如HF、NH3、醚、醇以及胺类等反应,有的形成加合物。
- BCl3遇水发生强烈的水解反应。
- 氟硼酸又称四氟硼酸,氢氟硼酸,英文名称Fluoroboric acid, 分子式为HBF4。无色透明液体,强酸,不能以纯态存在,只能在水溶液中存在。工业品一般为42%~48%左右的水溶液,42%水溶液的相对密度为1.32;48%水溶液的相对密度为1.37。氟硼酸在浓溶液中稳定,加热到130℃时分解。能和水或醇相混溶。在水溶液中缓慢分解生成羟基氟硼酸(HBF3OH)。与玻璃表面接触时稳定性逐渐下降,0.047mol/L氟硼酸溶液在玻璃容器里保存32天后水解度由20.6%上升至72.6%。具有强腐蚀性,但在常温下不侵蚀玻璃;能同金属元素、金属氟化物、氧化物、氢氧化物或碳酸盐反应生成相应的氟硼酸盐,有毒;用于金属表面氧化物、硅酸盐膜的清洁和腐蚀剂,铝和合金电镀前的清洗。2.5%溶液用于电解抛光纯铝和从金属基体上除去焊药及电镀零件的再洗液; 用作烷基化和聚合的催化剂,防腐剂,化学试剂,以及制备各种氟硼酸盐的原料。
- 硼酸化学式H2BO3,英文名称Orthoboric acid,相对密度1.43g/cm³,熔点169℃,沸点300℃,白色结晶性粉末或无色微带珍珠状光泽的鳞片,无气味,味微酸苦后带甜,有滑腻手感,露置空气中无变化,能随水蒸气挥发;硼酸被广泛应用于玻璃、搪瓷、陶瓷、医药、冶金、皮革、染料、农药、肥料、纺织等工业。具体应用请参见硼酸页面。
 硼砂或称粗硼砂,四硼酸钠(十水),月石砂,黄月砂,月石砂,四硼酸钠等;英文名称Borax,Sodium tetraborate等,其化学式:Na2B4O7•10H2O,沸点: 1575℃,熔点: 约880℃,密度为1.73 g/cm³,莫氏硬度2.0~2.5。硼砂通常为含有无色晶体的白色粉末(颜色有白中带灰或带浅色调的黄、蓝、绿等),具有玻璃光泽,晶体为板状或柱状,晶体集合在一起形成晶簇状、粒状、多孔的土块状等,可溶于水。由于分子中有过量的氧化硼,熔融的硼砂能溶解多种金属氧化物和盐,并依金属不同而显特征的颜色。在化学分析上常用硼砂试验来鉴定金属离子。硼砂是玻璃和搪瓷工业的原料,在焊接中常用硼砂作助焊剂。硼砂也是肥皂和洗涤剂的添加剂,另外可作消毒剂、保鲜防腐剂、软水剂、洗眼水、杀虫剂、化妆品、陶瓷的釉料和玻璃原料等,在工业生产中硼砂也有着重要的作用,另也可用于配置缓冲溶液和制取其他硼化合物等。
硼砂或称粗硼砂,四硼酸钠(十水),月石砂,黄月砂,月石砂,四硼酸钠等;英文名称Borax,Sodium tetraborate等,其化学式:Na2B4O7•10H2O,沸点: 1575℃,熔点: 约880℃,密度为1.73 g/cm³,莫氏硬度2.0~2.5。硼砂通常为含有无色晶体的白色粉末(颜色有白中带灰或带浅色调的黄、蓝、绿等),具有玻璃光泽,晶体为板状或柱状,晶体集合在一起形成晶簇状、粒状、多孔的土块状等,可溶于水。由于分子中有过量的氧化硼,熔融的硼砂能溶解多种金属氧化物和盐,并依金属不同而显特征的颜色。在化学分析上常用硼砂试验来鉴定金属离子。硼砂是玻璃和搪瓷工业的原料,在焊接中常用硼砂作助焊剂。硼砂也是肥皂和洗涤剂的添加剂,另外可作消毒剂、保鲜防腐剂、软水剂、洗眼水、杀虫剂、化妆品、陶瓷的釉料和玻璃原料等,在工业生产中硼砂也有着重要的作用,另也可用于配置缓冲溶液和制取其他硼化合物等。
- 硼几乎与所有金属都生能成金属型化合物。它们的组成一般为M4B、M2B、MB、M3B4、MB2及MB6,如Nb3B4、Cr4B、LaB6、…等。这些化合物一般都很硬,且耐高温、抗化学侵蚀,通常它们都具有特殊的物理和化学性质。金属硼化物在高温下耐磨性好,热压B4C+TiB2陶瓷、硼化铬在微氧化气氛中与氧化铝烧结或热压制品,均有高温耐磨实用价值。
- CrB2与TiB2的抗氧化温度高于1400℃,它们能生成致密氧化膜。
- 硼化钛、硼化锆用于抗熔融Al、Zn渣腐蚀槽板,坩埚、泵闸、喷嘴等耐蚀、耐磨部件。
- 过量的硼酸与金属氧化物加炭黑在高温H2中反应,可以制得金属硼化物。
- 金属间化合物-钕铁硼
 钕铁硼永磁材料化学式:Nd2Fe14B,是以金属间化合物RE2FE14B为基础的永磁材料,主要成分为稀土(RE)、铁(FE)、硼(B)。其中稀土Nd为了获得不同性能可用部分镝(Dy)、镨(Pr)等其他稀土金属替代,铁也可被钴(Co)、铝(Al)等其他金属部分替代,硼的含量较小,但却对形成四方晶体结构金属间化合物起着重要作用。
钕铁硼永磁材料化学式:Nd2Fe14B,是以金属间化合物RE2FE14B为基础的永磁材料,主要成分为稀土(RE)、铁(FE)、硼(B)。其中稀土Nd为了获得不同性能可用部分镝(Dy)、镨(Pr)等其他稀土金属替代,铁也可被钴(Co)、铝(Al)等其他金属部分替代,硼的含量较小,但却对形成四方晶体结构金属间化合物起着重要作用。- 钕铁硼磁性材料,由于其优异的磁性能而被称为“磁王”,又称磁钢。 钕铁硼具有极高的磁能积和矫顽力,同时高能量密度的优点使钕铁硼永磁材料在现代工业和电子技术中获得了广泛应用,从而使仪器仪表、电声电机、磁选磁化等设备的小型化、轻量化、薄型化成为可能。钕铁硼的优点是性价比高,具良好的机械特性;不足之处在于居里温度点低,温度特性差,且易于粉化腐蚀,必须通过调整其化学成分和采取表面处理方法使之得以改进,才能达到实际应用的要求。
- 硼杂环化合物(有机硼杂环化合物)是一类在环上含有一个或多个硼原子的杂环化合物。硼杂环中除硼、碳外,尚可有氧、硫、氮、磷、硅等原子。主要分为四类:(1)杂环脂,包括饱和环,如硼杂戊环、硼杂己环以及不饱和环或环上含有其他杂原子者;(2)硼杂芳环,主要是具有芳香性的芳烃环,如硼氮六环、硼氧六环、硼杂芳烃等;(3)网络状硼杂环,如硼杂二环壬烷、硼杂金刚烷等;(4)螯合型硼杂环,包括硼酸和烃基硼酸或胺基酸衍生物,含N、O、S多官能有机硼配合物等。硼杂环化合物可用作治癌药物、生理活性物质、还原剂等。
- 过硼酸盐
- 将硼酸盐与H2O2反应或者让H3BO3与碱金属的过氧化物反应,都可以得到过硼酸盐。过硼酸钠NaBO3• 4H2O是强氧化剂,水解时放出H2O2,用于漂白羊毛、丝、革和象牙等物或加在洗衣粉中作漂白剂。过硼酸钠的分子结构尚未弄明白,可看作是含H2O2的水合物NaBO2• H2O2• 3H2O。它是无色晶体,加热失水后成为黄色固体。
- 氮化硼
- 将硼砂与NH4Cl一同加热,再用盐酸、热水处理、可得到白色固体氮化硼BN。在高温下用硼和氨或氮作用也可得BN。BN具有石墨型晶体结构,层内的硼原子和氮原子均采取sp2杂化轨道相互结合。结构中B-N基团同C-C基团是等电子体。BN耐腐蚀、热稳定性好,在3272K的高温下仍保持稳定的固体状态。它的电阻大,导热率大,绝缘性能好。当前它主要用作润滑材料,耐磨材料,电气和耐热的涂层材料。
- 在高温高压下,石墨晶形的BN可转化为金刚石型立方晶系的BN。这种金刚石结构的BN的硬度可与金刚石的硬度相比拟。
- 目录
Boron
- 介绍
- 发现
- 性质
- 制备工艺
- 应用
- 世界分布
- 中国储量
- 化合物
- 硼烷
- 硼酸
- 毒性作用
- 人体影响
- 生物影响
- 行业标准
- 名企
- 矿物
- 推荐
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- 涨 ▪ 知识





