- 硼烷
- 硼的氢化物是指硼与氢组成的化合物的总称,又称为硼烷,英文名称Borane,它可以用化学通式BxHy表示。这类化合物都是通过人工合成得到的。
- 硼烷分子有两种类型:BnHn+4和BnHn+6 。现在已制得二十多种硼烷。主要有乙硼烷(B2H6)、丙硼烷(B3H9)、丁硼烷(B4H10)、戊硼烷(B5H11)、己硼烷(B6H12)和癸硼烷。随着硼原子数的增加,硼烷可由气态(如乙硼烷、丁硼烷)变成液态(如戊硼烷、己硼烷)再变成固态(如癸硼烷)。
- 硼烷都具有难闻的臭味,化学性质十分活泼,与空气接触时会发生爆炸性的分解,并可发生水解、卤化、胺化、氢化、烷基化、醇解等反应,也可与金属有机化合物反应。由于硼元素位于化学元素周期表第Ⅲ主族,具有较强的还原性(容易被氧化),因此硼烷类化合物大多遇氧气和水不稳定,需要在无水无氧条件下(惰性气体保护)保存。
- 硼烷在近代工业和军事上具有重要用途,由于它发热量高、燃烧快,被用作火箭和导弹的高能燃料。此外,还用作金属或陶瓷零件的处理剂,硅橡胶中的交联剂。硼烷毒性大,会损害人体的肺、肝和肾。
- 硼烷的理化性质
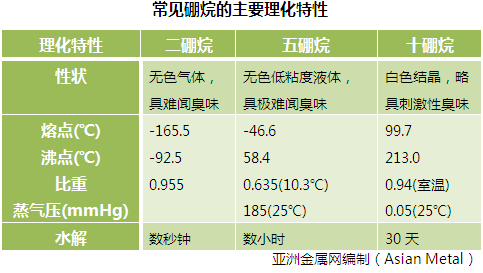
- 单的硼烷应该是BH3 ,但这一化合物不能单独存在,只存在其衍生物,因此,硼烷中的第一个成员是B2H6。乙硼烷易溶于乙醚(例如:乙硼烷与含双键或叁键的有机化合物在醚溶液中发生顺式亲电加成反应,生成烃基硼烷。),其余多数溶于苯。加热时易分解成硼和氢气,多数硼烷在空气中能自燃,硼烷燃烧时放出大量的热,所以可用作火箭的高能燃料,但这类物质毒性大,在一般条件下燃烧不完全。简单的硼烷无色,有难闻臭味,性质不稳定,有毒。硼烷分子中组成某些化学键的一对电子共享于3个原子之间,形成了三中心键(B-B-B键和B-H-B键)。可用卤化硼与氢化铝锂的反应制取,主要用作喷气飞机和火箭的高能燃料。
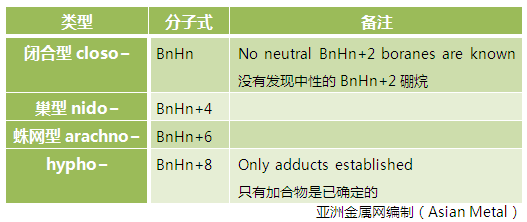
- 单簇硼烷化合物可以用以下四种通式表示,其中n表示硼原子个数:
- 硼氢化物化学的范围已扩大至不仅含硼原子还可能还有碳、金属原子等其他。如在碳硼烷、金属硼烷中一个或多个硼原子被碳原子或金属原子取代。
- 硼元素位于化学元素周期表第Ⅲ主族,原子最外层有三个电子,能与氢原子(或硼原子)形成三个共价键,具有较强的还原性,常用作还原试剂。形成三个共价键的硼原子最外层含6个电子,并非八偶体结构,还有一个空轨道来接受孤对电子,比较容易与氮原子、氧原子、硫原子等含孤对电子对的原子形成配位键。市售的硼烷试剂如硼烷二甲硫醚、硼烷四氢呋喃、N,N-二乙基苯基硼烷等均是硼烷与其他实际形成配位键的形式保存。
- 乙硼烷燃烧:B2H6+3O2=B203+3H2O;硼烷水解时放出大量的热,如:B2H6+6H2O=2B(OH)3↓+6H2↑
- 因此硼烷类化合物遇水、遇氧气极不稳定,容易失效,因此在硼烷化合物的储存和运输过程要在无水无氧条件下进行。
- 硼烷的生产及应用简介
 乙硼烷有强还原性,可作还原剂。它跟氢化锂反应生成更强的还原剂硼氢化锂,用于有机合成。乙硼烷可用硼的卤化物在乙醚溶液中跟氢化铝锂LiAlH4反应制得。将乙硼烷加热到100~250℃得其它高硼烷。
乙硼烷有强还原性,可作还原剂。它跟氢化锂反应生成更强的还原剂硼氢化锂,用于有机合成。乙硼烷可用硼的卤化物在乙醚溶液中跟氢化铝锂LiAlH4反应制得。将乙硼烷加热到100~250℃得其它高硼烷。- 用量最大的是乙硼烷,主要由三氟化硼加工制得。硼烷都具有难闻的臭味,低级硼烷(硼原子数少)的化学性质十分活泼,与空气接触时会发生爆炸性的分解,可发生水解、卤化、胺化、氢化、烷基化、醇解等反应,也可与金属有机化合物反应。
- 最早制取硼烷的方法是用金属硼化物水解,因产率甚低,已不采用。工业上生产乙硼烷主要是利用三氟化硼与氢化锂在乙醚中作用制得:6LiH+2BF3─→6LiF+B2H6
- 硼烷在近代工业和军事上具有重要用途,由于它燃烧时能放出大量的热,主要用于火箭和导弹的高能燃料。此外,还可作为金属或陶瓷零件的处理剂,也可作为橡胶的交联剂,在硅橡胶生产中特别有效。
- 硼烷作为比较好的在有机化学合成中用到的手性定位选择还原剂,硼的有机类产品对于合成的选择还原也是不相同的。如德国巴斯夫、上海威智医药、上海镱晨生产的硼烷四氢呋喃络合物,硼烷二甲硫醚络合物、硼烷吡啶络合物、儿茶酚硼烷、频哪醉硼烷、2-甲基吡啶硼烷、N、N-二乙基苯胺硼烷、三乙基硼,二乙基(3-吡啶)基硼烷等,在新药的合成手性定位还原方面,用作很重要的用途。
- 新药的合成手性定位还原用到最多的催化剂为(R)-2-甲基-CBS-恶唑硼烷、(S)-2-甲基-CBS-恶唑硼烷、二异松蒎基氯硼烷。他们通过把药物分子中的醛基、酮基直接还原为具有特定手性的醇类,因此应用十分广泛,尤其是在国内外一些高附加值的药品的生产过程中。
 硼烷可与烃基、氨基、卤素及金属结合而生成多种衍生物,与乙基、丁基、苯基等结合即形成液态有机硼化合物。有机硼烷BR3,分子中R为烷基,是有机硼化合物中用途很多的一类化合物。其主要反应是用各种方法使碳硼键断裂而生成烃类、醇类、酮类和其他一系列的化合物,如BR3与碱性过氧化氢反应生成醇,用酸分解生成烷烃,用铬酸氧化生成酮。有机硼烷在160℃发生异构化,使硼原子从碳链的中间转移到碳链的末端,从而生成一系列的衍生物。硼烷及其衍生物在现代工业和国防上有重要用途。除作火箭和导弹的高能燃料外,还用于金属或陶瓷的表面处理,橡胶硫化以及多种有机合成等生产。硼烷均溶于烃类溶剂。水解的最终产物为硼酸和氢。燃烧的最终产物是氧化硼。
硼烷可与烃基、氨基、卤素及金属结合而生成多种衍生物,与乙基、丁基、苯基等结合即形成液态有机硼化合物。有机硼烷BR3,分子中R为烷基,是有机硼化合物中用途很多的一类化合物。其主要反应是用各种方法使碳硼键断裂而生成烃类、醇类、酮类和其他一系列的化合物,如BR3与碱性过氧化氢反应生成醇,用酸分解生成烷烃,用铬酸氧化生成酮。有机硼烷在160℃发生异构化,使硼原子从碳链的中间转移到碳链的末端,从而生成一系列的衍生物。硼烷及其衍生物在现代工业和国防上有重要用途。除作火箭和导弹的高能燃料外,还用于金属或陶瓷的表面处理,橡胶硫化以及多种有机合成等生产。硼烷均溶于烃类溶剂。水解的最终产物为硼酸和氢。燃烧的最终产物是氧化硼。- 碳硼烷
- 具有以硼和碳原子组成的笼形化学结构。例如1,2-二碳代十二硼烷C2B10H12是由10个硼原子和两个邻碳原子组成的正二十面体笼形硼化合物。这种碳硼烷的熔点为294.5~295.5℃,性能稳定,不易氧化和水解。
- 目录
Boron
- 介绍
- 发现
- 性质
- 制备工艺
- 应用
- 世界分布
- 中国储量
- 化合物
- 硼烷
- 硼酸
- 毒性作用
- 人体影响
- 生物影响
- 行业标准
- 名企
- 矿物
- 推荐
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- 涨 ▪ 知识





